エネルギーを示す。βは負の値なので、α+2βのエネルギーを持つ分子軌道が最も安 定である。 前回学んだアリルカチオン、1,3ブタジエンの分子軌道と大きく異なる特徴は、同じ エネルギーを持つ分子軌道があることである。すなわち、α+β・αβのエネルギーI6 エネルギー準位、π電子エネルギー 2点×2 I1) 次の手順 a)d)に従い、エチレンのπ軌道を導出せよ。 a) 分子軌道を炭素原子 2p z軌道の線形結合で近似し(LCAO 近似)、一電子ハミルトニア ンhを用いて全エネルギーεを導け。 b) 重なり積分 S、クーロン積分α、共鳴積分βを用いてエネルギーを暯分子軌道は、エチレンの結合性軌道よりもエネルギーが低い。つまり、アリルカチオン の方が電子の安定化が大きいことがわかる。 4 1,3ブタジエンのπ分子軌道 次に、1,3ブタジエンのπ分子軌道について考えてみよう。
講義 有機化学1 第15回目の講義から 1 分子軌道法について エチレンとブタジエンのp結合について 片桐教授 東京工科大学 工学部 応用化学科 ブログ
ブタジエン 分子軌道 エネルギー準位
ブタジエン 分子軌道 エネルギー準位-MathematicaによるHuc¨ kel分子軌道法の計算 KENZOU 05年x月x日 これからMathematica を使ってHuc¨ kel の分子軌道法を勉強していくことにします。 よく知られているようにHuc¨ kel の分子軌道法の計算は大変簡単で電卓で容易にできるといわれています。すなわち,エネルギー準位として(エネル ギーが低い順に) E = 1 618 ;




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
0 618 ;トランスブタジエンの4個のπ軌道は右図のように書ける。 次の遷移が許容遷移か禁制遷移かを判定せよ。 Ψ 3→Ψ 2, Ψ 4→Ψ 2, Ψ 3→Ψ 1, Ψ 4→Ψ 1 ヒント トランスブタジエンに対する対称操作は、 恒等操作E、2回軸回転C 2、対称中心に関 する反転i、分子面にトリメチレンメタンの全エネルギー 4d 2 3e 孤立したエチレン2 分子の全エネルギー 4d 4e なので孤立したエチレン2 分子の方が安定である。 i4 ヒュッケル分子軌道法を用いて,ビシクロブタジエンのs 電子軌道エネルギーとs 電子全 エネルギーを求めよ。 1 2 4 3
16 共役π 電子系~単純 Hückel 法~ 分子軌道法の簡単かつきわめて有用な応用に,共役 電子系に対する Hückel 法がある。 共役 電子系とは,一重結合と二重結合が交互に現れるような系である。 (副読本 pp 142~162)分子軌道計算の実行 11 Hückel 法に ルギーも同時に表示されるが、準位がπ*以上 の軌道はすべてエネルギーの符号が正であ ることから、これらの軌道が不安定であること がわかる。 以上がコンピュータを用いた分子軌道計算 のあらましである。紙と鉛筆だけで計算するよ りもはるかに早くブタジエン: E π = 2 e 1 2 e 2 = 2(a 162 b) 2(a 062 b) = 4 a 448 b より、 E π ( ブタジエン ) - 2 E π ( エチレン ) = –048 b :非局在化による安定化 1 プロペン (CH 2 =CH–C • H 2 ) の π分子軌道
この分子に紫外線を当てで電子を励起してやると、電子はエネルギーを吸収してより高いエネルギー準位 に飛び移っていくんだが、その中で電子の詰まった最高エネルギー準位から次の最も低いエネルギー準位 に飛び移る電子に注目しよう。このあたりの状況を図5 に描いておくけど、エネルギー差に相当する光が分子軌道のエネルギー準位図の基礎その2基礎その1で紹介した水素分子の軌道エネルギー準位図について、もう少し解説する。存在する2つの分子軌道は、そもそもそれぞれ フロンティア軌道法 入門編3 有機化学勉強会 ホーム ピグ アメブロ 芸能人ブログ 人気ブログ Ameba新規登録(無料ブタジエン分子の基底状態 分子軌道の模式図 最低励起エネルギーはψ 3 ←ψ 2 の電子遷移によるから ∆ E = α– 0618β– α– 0618β= – 1236β



単純ヒュッケル法による分子軌道の計算と共鳴安定化



ディールスアルダー反応 この世を科学的に知ろう
図1 ベンゼン(左)とシクロブタジエン(右)の分子軌道エネルギー準位。ベンゼンでは全ての電子 が対を作り閉殻構造であるのに対し、シクロブタジエンでは不対電子が2つのジラジカルであ ることが①4つのエネルギー準位のエネルギー ②全エネルギーeπ ③非局在化エネルギー を求め,ブタジエンの例にならってエネルギー準位図を描いて基底電子 配置を示せ. 6月10日,番号,氏名 12 4 3 α β α β α β α β π π π π 162 062 062 162 1 2 3 4 = = = − = − e e e e * * c2pⅡ.分子軌道及び軌道エネルギーの意味 分子軌道 の絶対値を二乗し,占有数 を掛けてすべての被占軌道について足し合わせる と,系の各点での電子密度 が得られます。電子密度を求めるために使ったこの分子軌道そ のものは観測できません1。 (1) HartreeFock 法で得ら れる分子 軌道は正準




1 C2h4 Lihat Cara Penyelesaian Di Qanda




反結合性軌道 Wikipedia
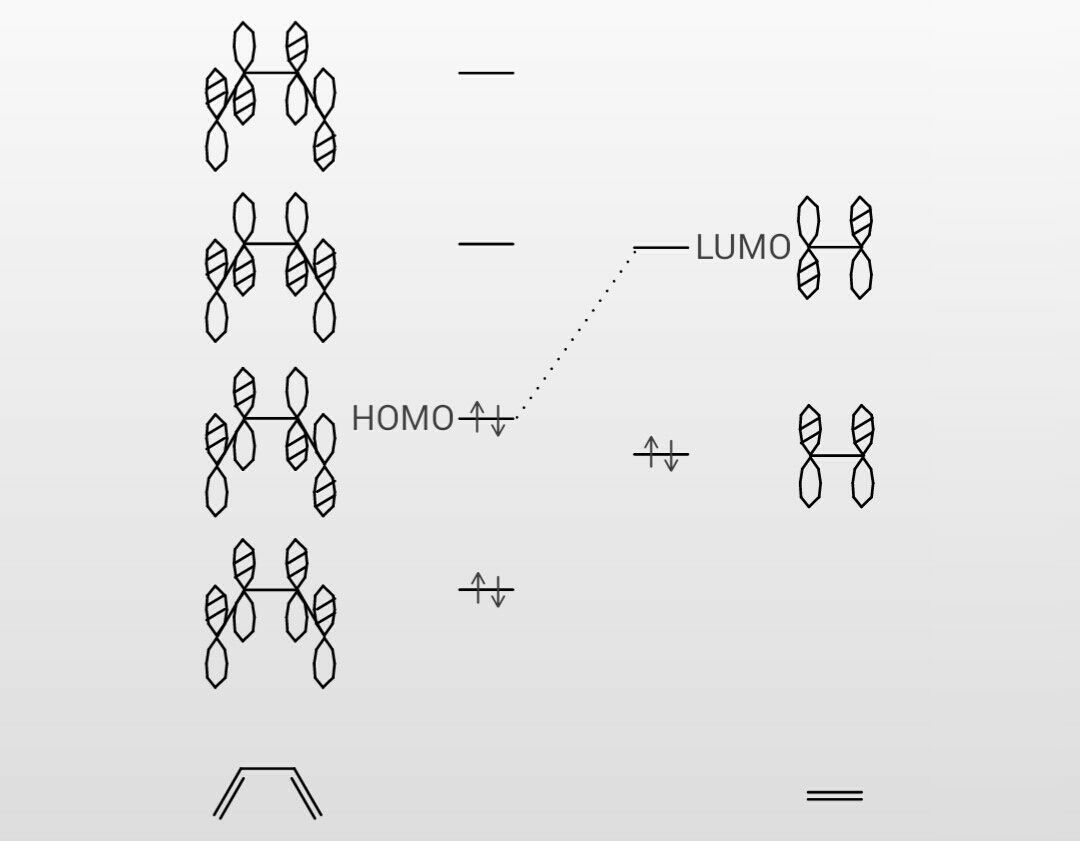
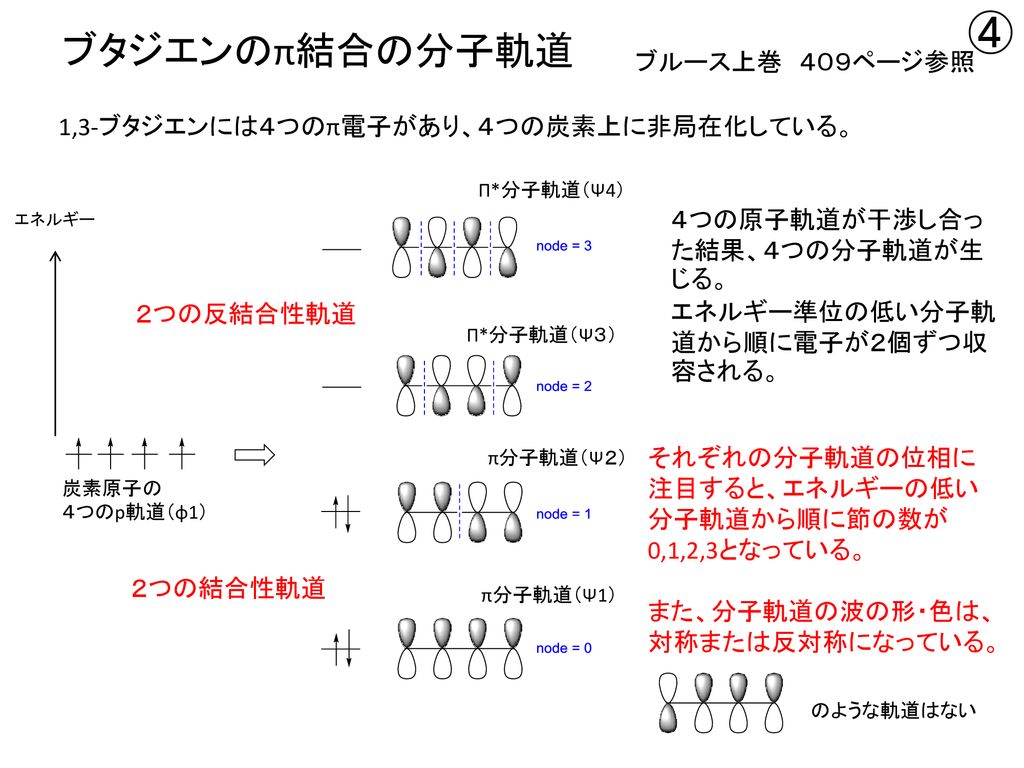
1 618 の4 つが得られる。 · (1)①1,3ブタジエン : 四つのπ電子は、エネルギー準位の低い方から二つ目のπ軌道(π1とπ2)まで入っている。 ②1,3,5ヘキサトリエン : 六つのπ電子は、エネルギー準位の低い方から三つ目のπ軌道(π1とπ2とπ3)まで入っている。つまり電子が存在している軌道のうち、最もエネルギーが高い軌道のことを指す。1,3ブタジエンの軌道を示している下の図で青色で囲んでいる軌道がHOMOとなっている。 それに対し、LUMOは「Lowest Unoccupied Molecular Orbital」のことであり、最低空軌道と訳される。LUMOは電子がない空の軌道のうち、最もエネルギーの低い軌道のことを指す。




17 号 ペロブスカイトベースのデバイス用ドーピング操作正孔輸送層 Astamuse




ヨウ素とは ヨウ素学会
電子に占められているエネルギーの最も高い分子軌道を最 図3 ブタジエンのhomo(半透明)とエチレンのlumo (網目状)の重なり:対称面(点線)に関してともに反対称 で両反応点において同位相の重なりをもつ 講 座 講座 世の中を変えた反応・材料・理論 30 化学と教育 67 巻1 号(19 年0 618 ;分子では,等核の場合と同じようにして分子軌道を構成する ことができる.テキストp70から71には,一酸化炭素の分子 軌道エネルギー準位図について解説されている. これらの説明およびテキストp71の図355(下図)を基本と




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1
ブタジエンの分子軌道 ブタジエンになると、p軌道が4つになり電子も4つになります。p軌道の方向で組み合わせを考えると4種類あることがわかります。下の青の軌道( π1、π2)は、少なくとも2つの軌道が重なりますが、上の赤い軌道(π * 3、π * 4)では、重なりが無く不安定だということが · そして軌道エネルギー準位図を作成しました。 さて、線形代数学(C)の講義の固有値問題の話で述べたように、ブタジエンの場合はヒュッケル分子軌道法で4つの固有値=eigen valueが求まります。このeigen valueと言うことばはもともと量子力学でディラックさんがつくったことばだそうです。その意味では数学もその応用分野の要請で発展していることがわかり電子のエネルギー 分子 結晶 電子は動き回ることができる 運動 エネル ギー 運動 エネル ギー 小 結晶における電子のエネルギー 4e 4e 4e 4e 4e 4e 4e 4e 4e 4e 4e 4e 電子 ホール 運動 エネルギー 結晶における電子のエネルギー 0 k E エネルギー バンド 禁制帯 自由電子近似からみた固体




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ




18 号 電線 ケーブル用樹脂組成物及び電線 ケーブル Astamuse
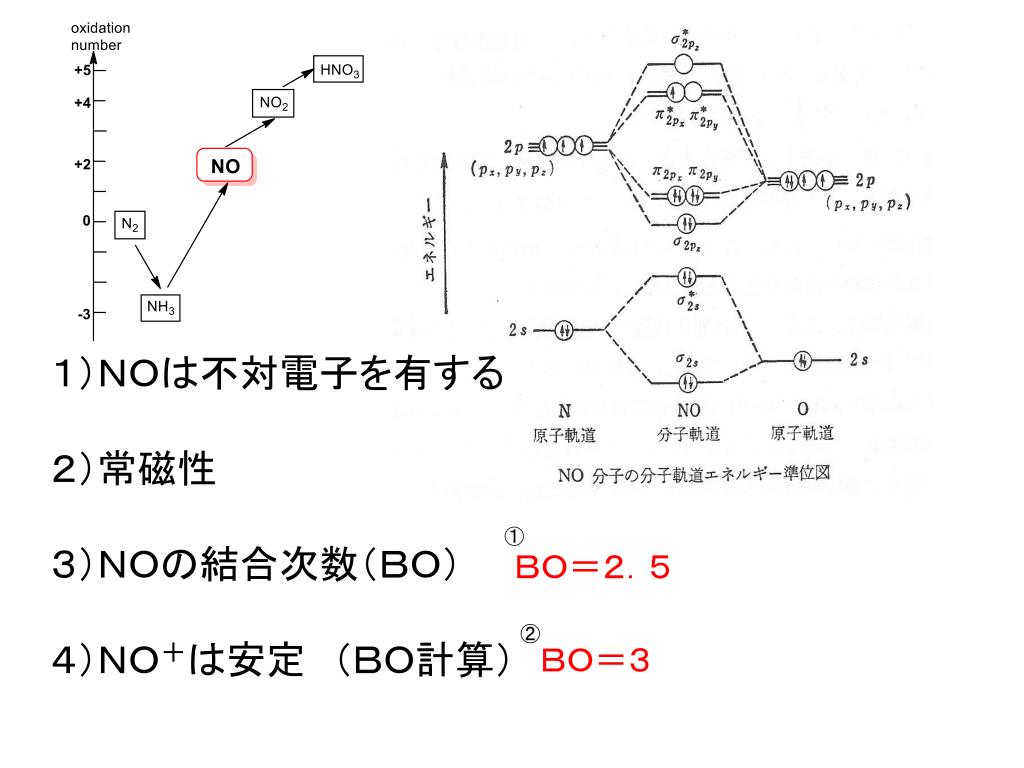
窒素分子N 2 (結合距離はÅ)は、もともとの窒素原子の1s軌道同士、2s軌道同士および2p z 軌道同士から3組のσσ*軌道を作ります。 また2p x 軌道同士および2p y 軌道同士から2組のππ*軌道を作ります。 酸素分子O 2 とは異なり、前周期型なのでσ軌道とπ軌道のエネルギー順序が逆転していま4 に与えてある。分子軌道は、 エネルギーが高いほど破線で 示した節の数が多くなってい る。2pz 軌道にあった4 個の電 子はエネルギーの低い2 つの 分子軌道に入り、分子軌道を作った結果として、全部を合わせると、2 5b安定 化していることが解る。ブタジエンを「2 つのエチレンが合体したものと分子軌道の種類とエネルギー差 振動および回転準位 9 軌道エネルギーに基づく電子のエネルギー差よりも 振動および回転によるエネルギー差は小さい =それぞれの電子状態において様々な 振動・回転エネルギーを持つ状態がある 過程1:光吸収=s 0からs 1または 上位の励起状態への遷移



単純ヒュッケル法による分子軌道の計算と共鳴安定化
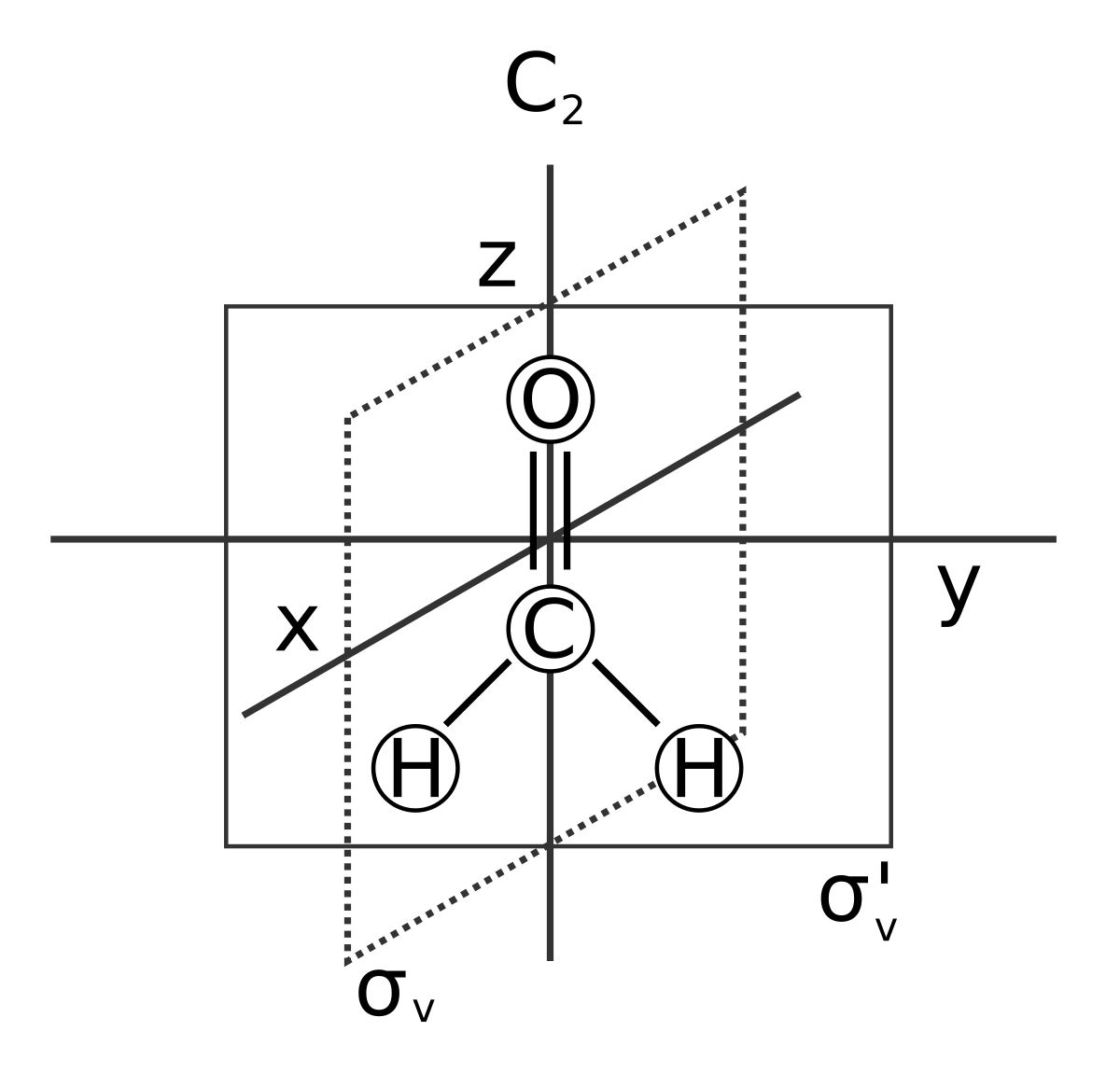



分子対称性 Wikipedia
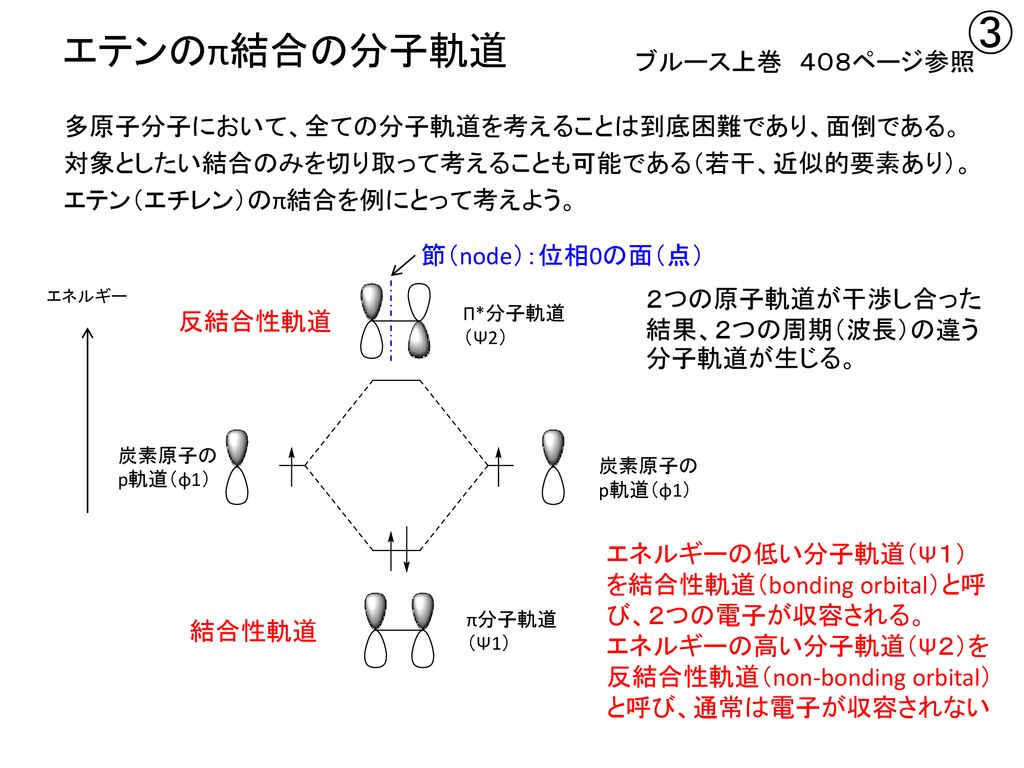
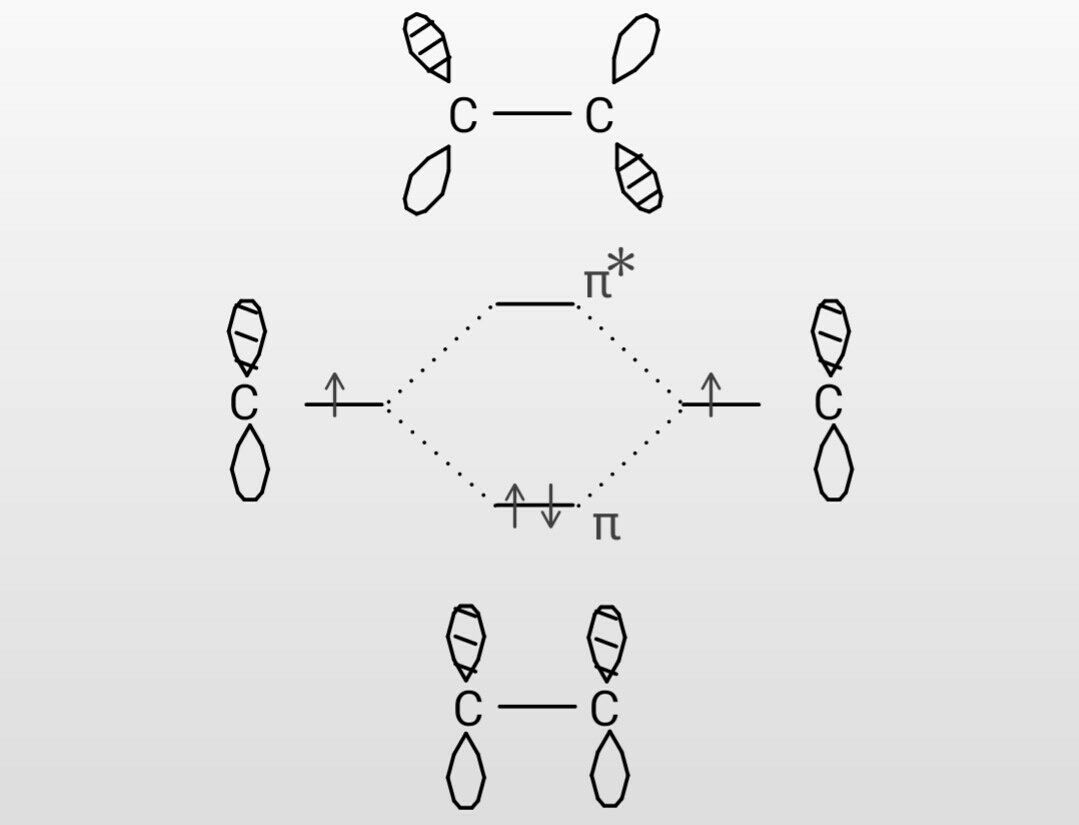
1112 · 電子が入っていない(空の)最もエネルギーが低い軌道はπ*軌道になります。 つまり、エチレンの場合は、HOMO=π軌道、LUMO=π*軌道となります。 エチレンの HOMOとLUMOはこのように簡単に求めることができます。 しかし、π電子の数が増えていくとπ軌道の数分子中の電子は,分子全体に広がった分子軌道molecular orbital に入っていると考えられる。様々なエネル ギー準位を持った分子軌道があるが,基底状態(最もエネルギーの低い状態)では,低いエネルギー準位の軌 道から順に2 つづつの電子が入っている。 波動関数がΨi,エネルギー準位がEi でN でnは偶数)のπ分子軌道 図3 ブタジエンシクロブテンの軌道相関図。熱過程許容は右側になると判断。 B 6電子系の電子環状反応 (1) MO準位を6つずつ描いて、A のように軌道相関図を作成する(図4)。遷移状態として逆旋側に Hückel縮重を、同旋側にMöbius縮重を挟む(図1参照)。分子軌道




High Performance Light Emitting Diodes Based On Carbene Metal Amides




分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
2 の分子軌道エネルギー準位図は次のとおり. no の分子軌道の配列は例題26a のCOとよく似ているが,窒素が炭素よりも電気陰性なので,原子軌 道と分子軌道の相対エネルギーが異なる.ここでσπクロスオーバーが起こるかどうか考えると,o 2 はσπクロスオーバーを示さないがn 2 は示すブタジエンのπ軌道は,エチレンのπ軌道の相互作用によって生成すると考えることができる.その際,近い軌道が強く相互作用するので,新しく生成する軌道はその影響を強くうける.2個のHOMO(φ)が接点で位相が合うように相互作用すると最下位の軌道Ψ 1 ,逆位相で相互作用すると2番目の軌道Ψ 2 が生成する.同様に2個のLUMOが相互作用すると軌道Ψ 3 および軌道Ψ 4 が1 エネルギーの近い軌道に重なりがあると, 軌道が混ざってエネルギーが変化する 2 元の軌道のエネルギーが近いほど, 重なりが大きいほど,エネルギーの変化は大きい 3 強め合う重なりはエネルギーが下がる(結合性軌道) 4 弱め合う重なりはエネルギーが上がる(反結合性軌道)



Ppt Sbo 分子軌道の基本概念を 説明できる 一酸化窒素の電子配置 と性質を説明できる 窒素酸化物の名称 構 造 性質を列挙できる Powerpoint Presentation Id




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
1) 化学結合の強さの支配因子は主に原子軌道のエネルギー準位である。低い準位の軌道が関与すれば強い。重なり積分は結合強度にそれほど大きな影響を与えない 2) 非共有電子対が結合の大きさに大きな影響を与える。交換反発で結合は弱くなるが、非共有電子対の超共役が作用すると結合は強化される。全エネルギーeπは, eπ= 2(α2β) 2α= 4α4β α2β eπ(ブタジエン)-2×eπ(エチレン)=4α4β2(2α2β) =0 つまり,シクロブタジエンでは非局在化安定化エネルギーはゼロである. 占有数 分子軌道係数 計算出力例 · 化学 分子軌道とかエネルギー準位図って? こんにちは。大学二年生です! 毎回お世話になっています。 分子軌道の問題なのですが、 「酸化マグネシウム分子の分子軌道のエネルギー準位図を表わし、それに基 質問No




17 1600号 イリジウム錯体 発光素子 表示装置 電子機器 及び照明装置 Astamuse
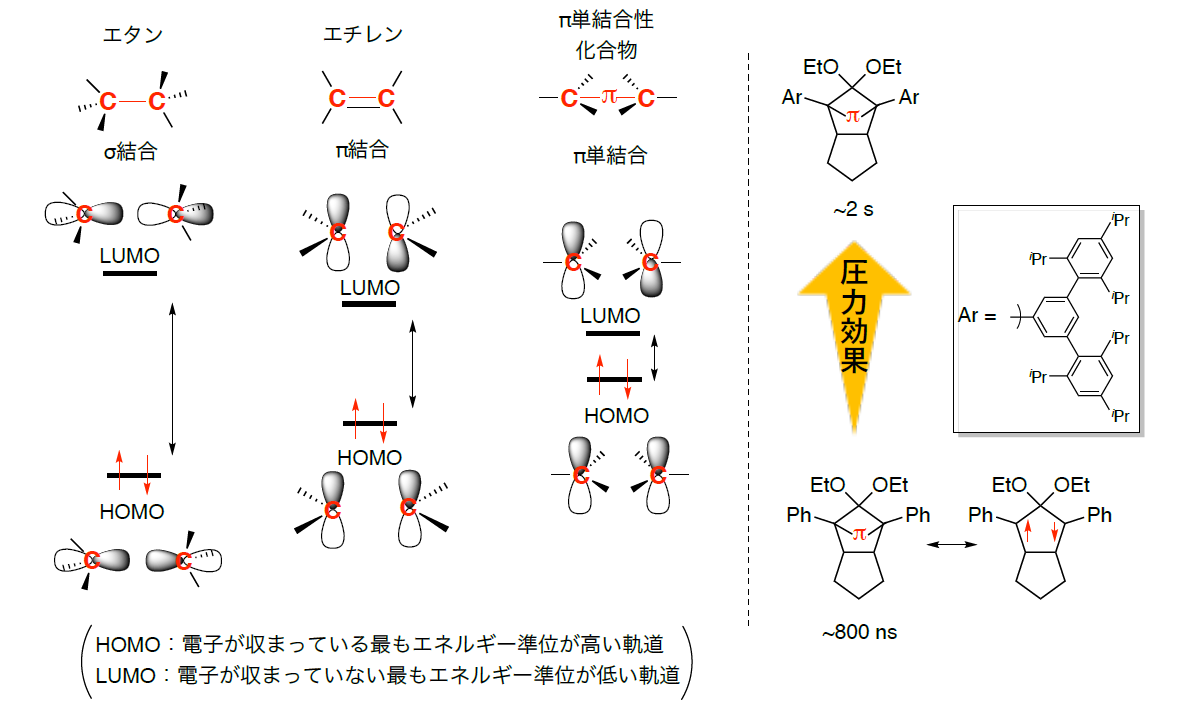



研究成果 炭素 炭素p単結合性化合物の寿命を圧力効果により約1000倍長くすることに成功 広島大学
下図右のように,エネルギーの高い軌道が真上になる ように書きます. 1s 2s 2p 1s 2s 2p これは変な書き方で, 普通はこうは書かない. 普通はこう書く エネルギー 1s 2s 3s 実際の軌道のエネルギー 2p(3つ) 4s 3p(3つ) 3d(5つ) 4p(3つ) 4d(5つ) 4f(7つ) エネルギー 1s 2s 2p x 2p y 2p z あとは,エネルギーの低い順分子軌道法(MO法)による共有結合の理解 2 軌道の形はこう描かれる 軌道関数の位相+、ーに絶対 的な意味はありません。 ただ"逆"なんだと思ってく ださい。 3 41 分子軌道法の基本的な考え方 節面 重ねると波動関数ゼロ =電子の存在確率ゼロ 同位相 逆位相 結合性 反結合性 波動関数の1.結晶場によるエネルギー準位の分裂 2.スピン・ハミルトニアン 3.JahnTeller (ヤーン・テラー)効果 21結晶場によるエネルギー準位の分裂 色々なイオン結晶磁性体の構造 Mn, Fe F, O K, La Cu, Mn F, O ルチル(tetragonal), MnF ペロブスカイト(cubic), KCuF3, LaMnO3 2, VO2 Li, Zn V, Cr, Fe 周囲の陰イオンが作る




分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



講義 有機化学1 第15回目の講義から 1 分子軌道法について エチレンとブタジエンのp結合について 片桐教授 東京工科大学 工学部 応用化学科 ブログ
分子の面に垂直な軌道となっている。π電子の結合 はσ結合に比べ弱くエネルギー準位が深くないために隣の原子へ自由に飛び移る。 ヒュッケル法(Huc kel method) 分子の波動関数を = c1ϕ1 c2ϕ2 c3ϕ3 c4ϕ4 (1) 異なるπ軌道の重なり積分を0とする。(ϕk;ϕ ′ k) = kK′,



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



May 28 16 この世を科学的に知ろう
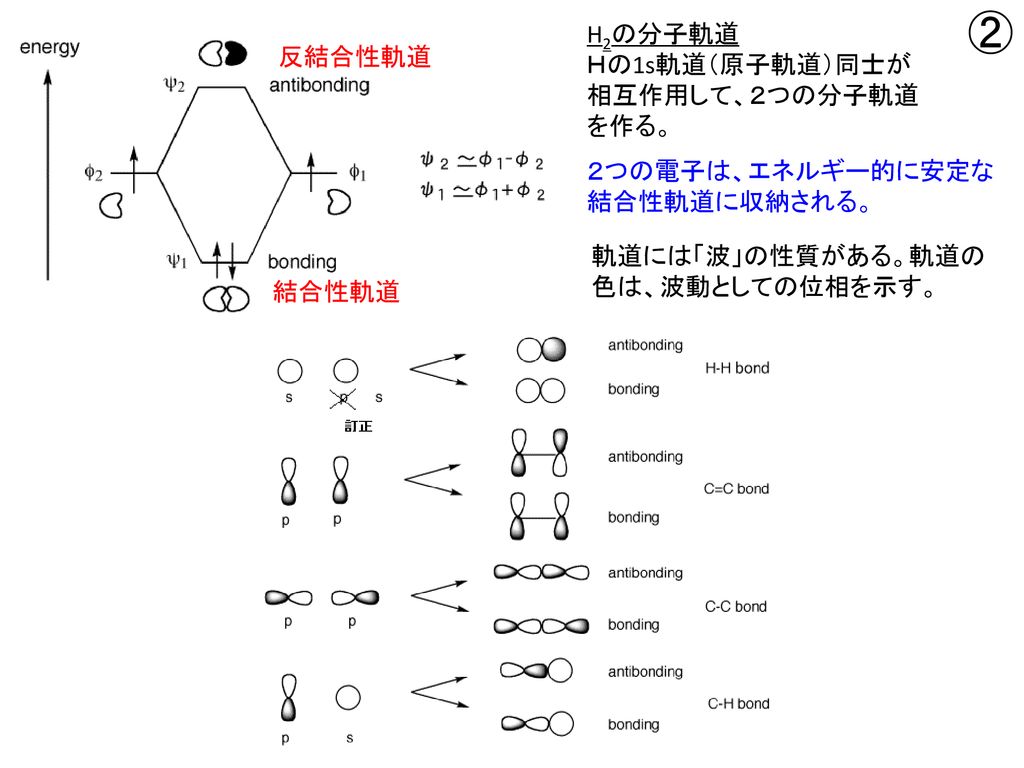



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



単純ヒュッケル法による分子軌道の計算と共鳴安定化
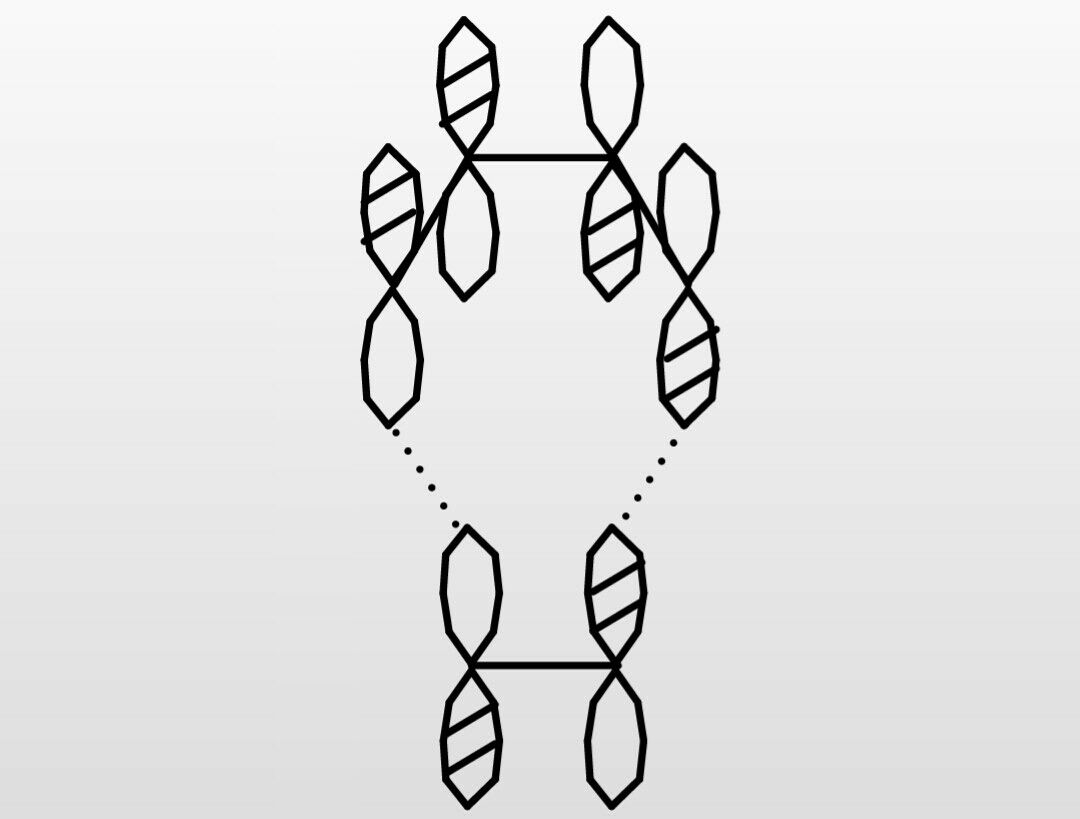



ディールスアルダー反応 この世を科学的に知ろう




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ




物性化学 Uc Garden
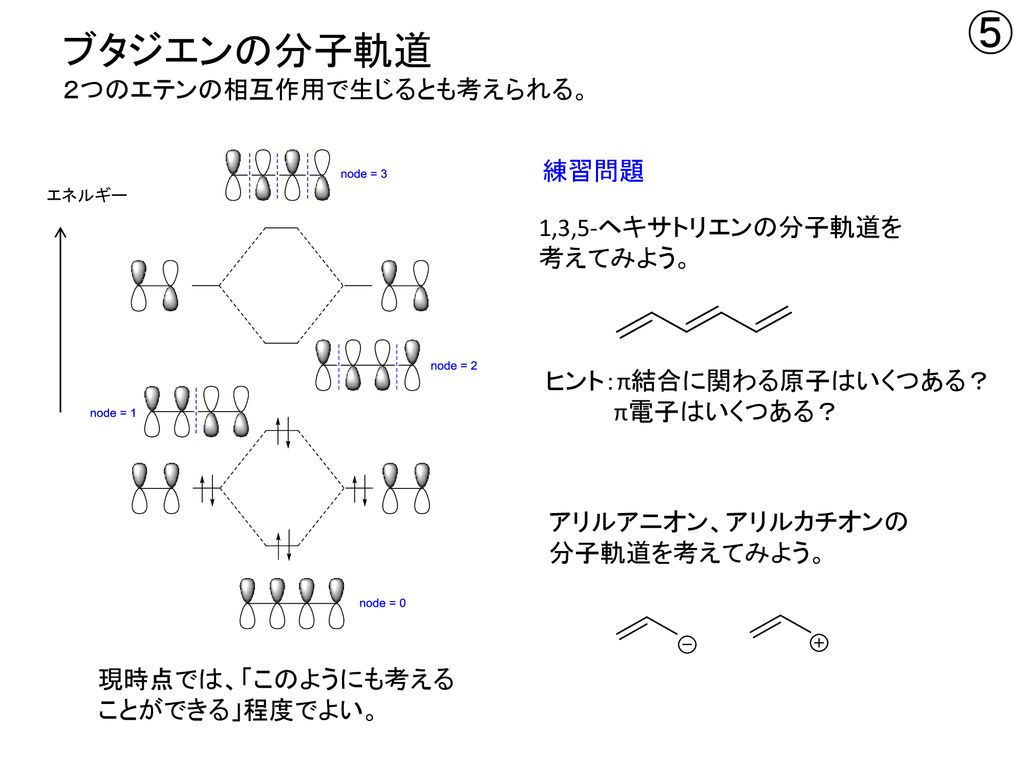



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
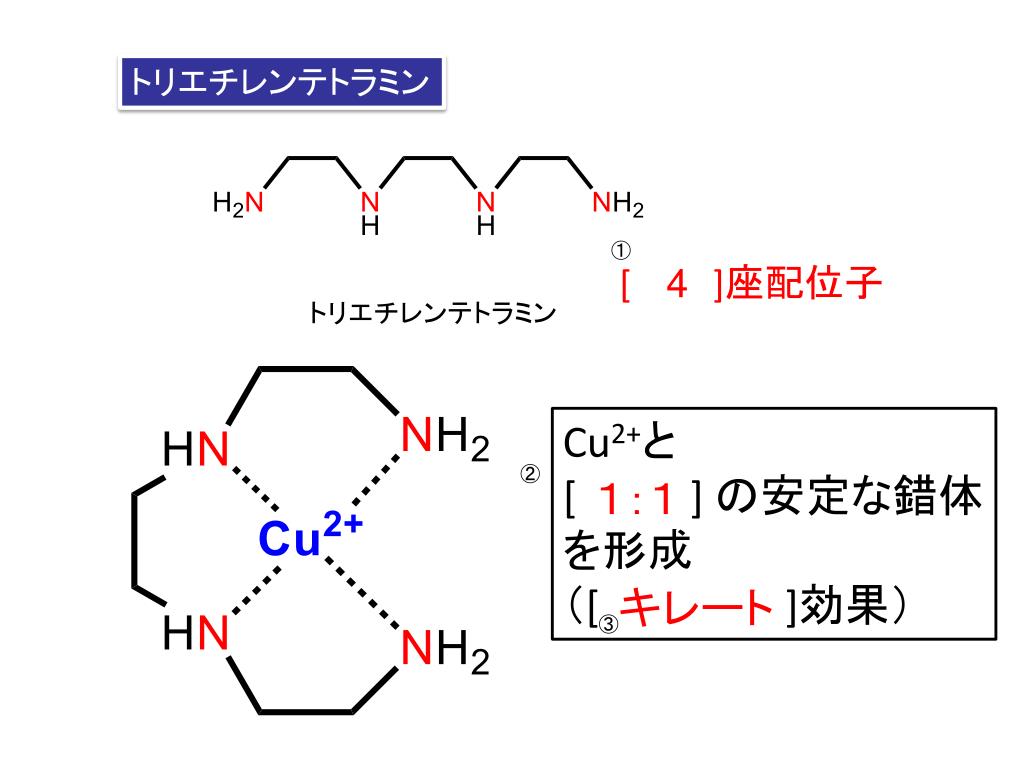



Ppt Sbo 分子軌道の基本概念を 説明できる 一酸化窒素の電子配置 と性質を説明できる 窒素酸化物の名称 構 造 性質を列挙できる Powerpoint Presentation Id
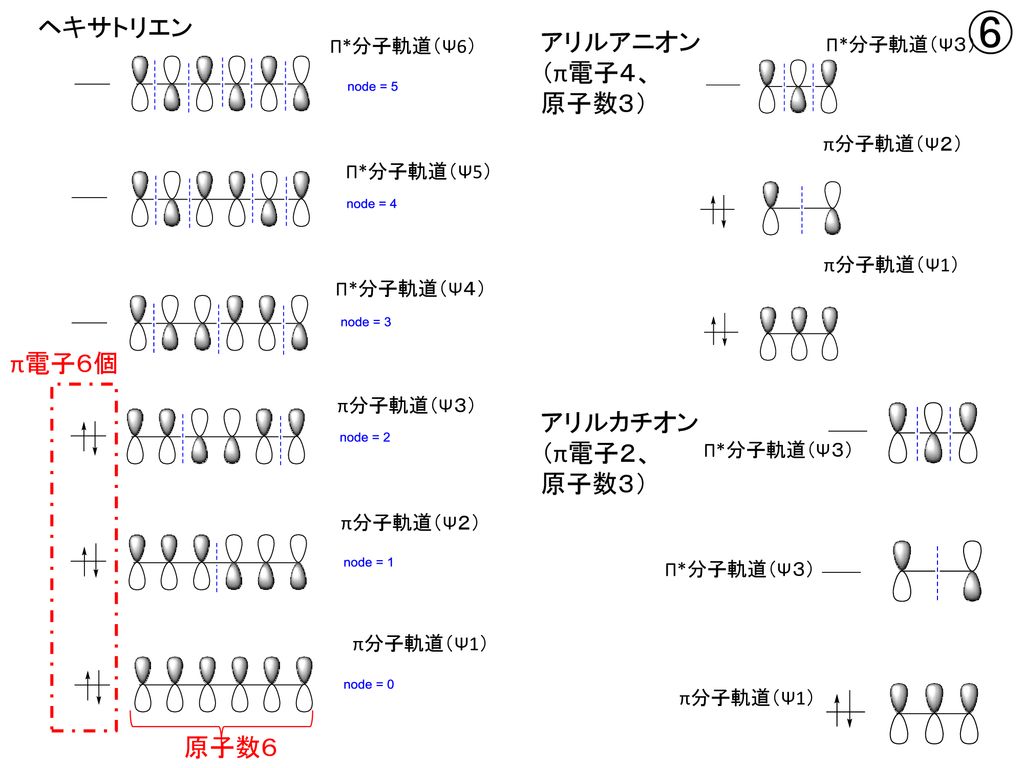



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
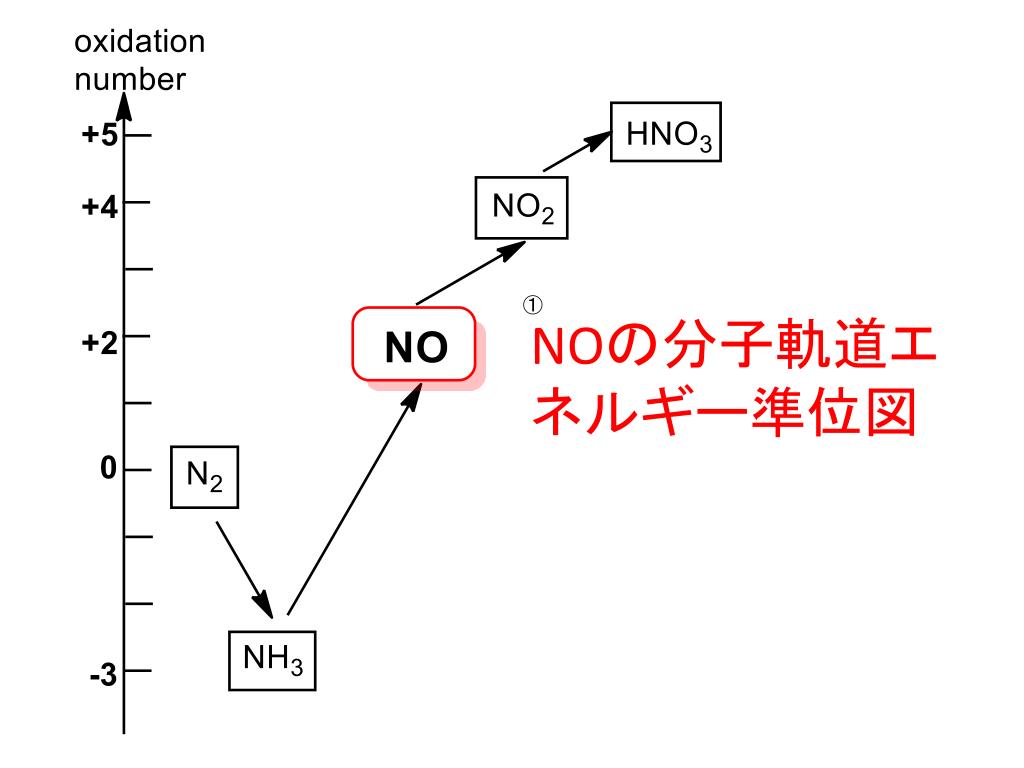



Ppt Sbo 分子軌道の基本概念を 説明できる 一酸化窒素の電子配置 と性質を説明できる 窒素酸化物の名称 構 造 性質を列挙できる Powerpoint Presentation Id




Ppt Sbo 分子軌道の基本概念を 説明できる 一酸化窒素の電子配置 と性質を説明できる 窒素酸化物の名称 構 造 性質を列挙できる Powerpoint Presentation Id




水の分子軌道について 水の分子軌道の形状についての質問させていただきます Okwave




Woa1 分子設計方法 プログラム ホスト材料 発光分子および有機発光素子 Google Patents




Paypayフリマ 化学 分子軌道法をどう理解するか 第2版 吉田政幸著 東京化学同人1997年3月3日




1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ




17 号 発光素子 表示装置 電子機器 及び照明装置 Astamuse




大学化学 化学結合論入門 分子軌道法i 結合性軌道 Youtube
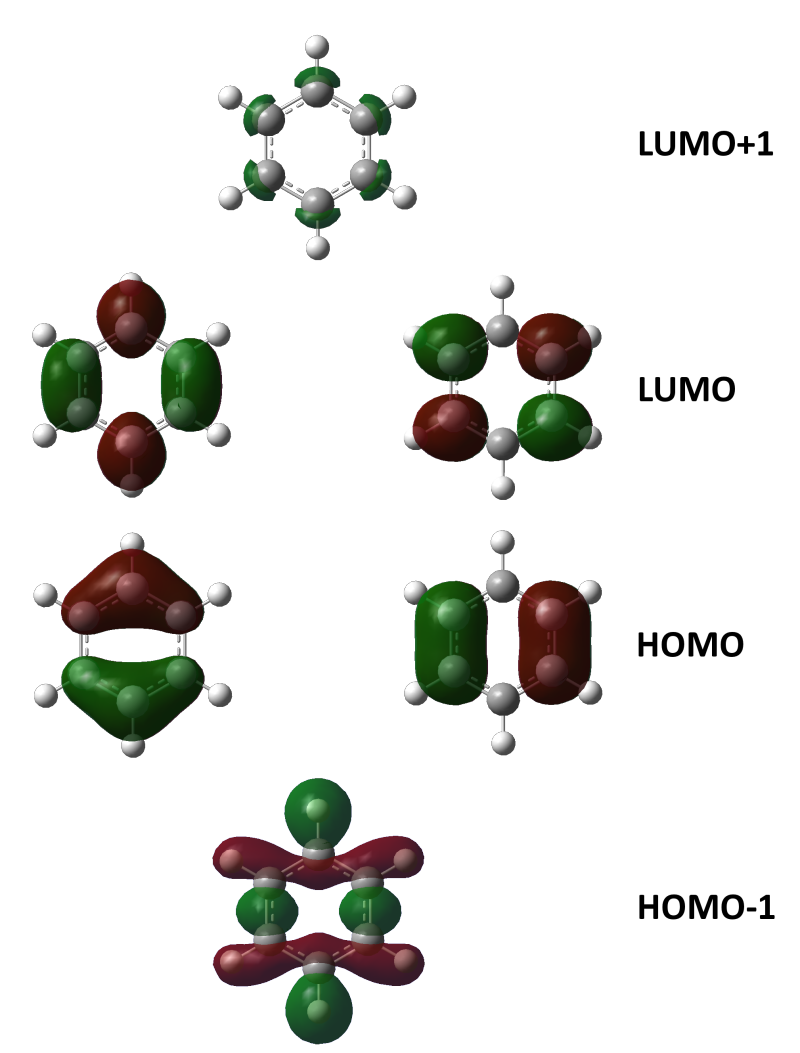



構造化学 ベンゼン 創薬メモ




1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1




Woa1 分子設計方法 プログラム ホスト材料 発光分子および有機発光素子 Google Patents




Paypayフリマ 化学 分子軌道法をどう理解するか 第2版 吉田政幸著 東京化学同人1997年3月3日



単純ヒュッケル法による分子軌道の計算と共鳴安定化




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ
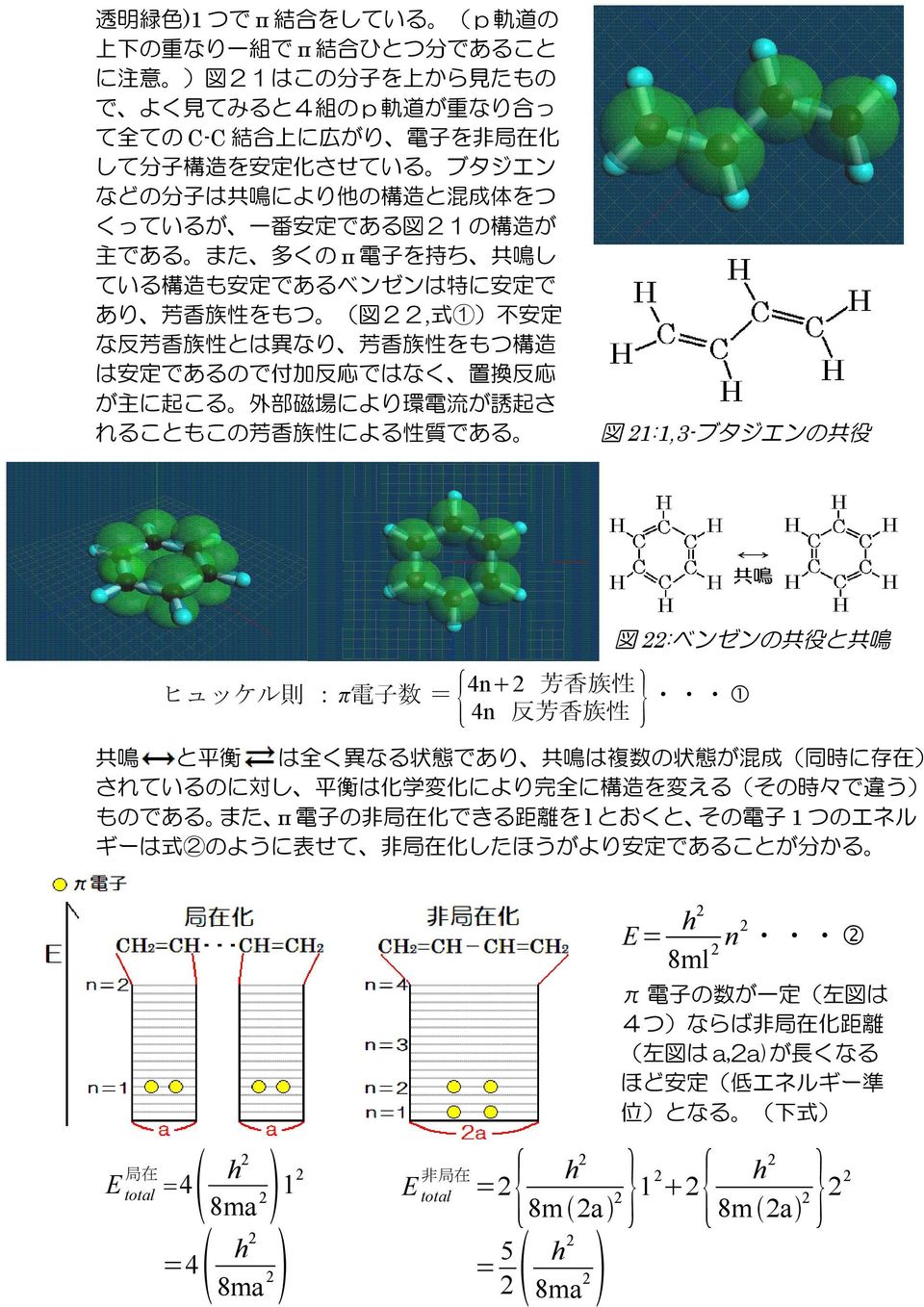



1 概要 基礎編1 1 宇宙の歴史 1 1 1 ビックバン後続過程 1 1 2 質量欠損 1 2 原子1 量子論 1 2 1 量子論への道のり 1 2 2 波動関数 1 3 原子2 電子 1 3 1



0 件のコメント:
コメントを投稿